Cách Cân Bằng Phản Ứng Oxi Hóa Khử Nhanh Nhat
Cách cân đối bội nghịch ứng lão hóa khử nhanh hao độc nhất chắc hẳn rằng luôn là sự việc nhưng các bạn học viên lưu chổ chính giữa độc nhất vô nhị. Để cân đối phản bội ứng ko chỉ cần sự sâu sắc, tứ duy cơ mà đề xuất cả một vài mẹo. Sau trên đây, banmaynuocnống.com xin chia sẻ cách thức làm cho bài bác hiệu quả tốt nhất.
Bạn đang xem: Cách cân bằng phản ứng oxi hóa khử nhanh nhat
I. Nội dung cách cân bằng làm phản ứng lão hóa khử
1. Cách thăng bằng bội phản ứng oxi hóa khử nkhô cứng nhất
Nội dung 1: Số oxi hoá, phương thức tính số lão hóa của ngulặng tố trong những hòa hợp chất hóa học
Số lão hóa của một nguyên ổn tố trong phân tử là số năng lượng điện của ngulặng tử đó vào phương pháp chất hóa học, tức hiểu đúng bản chất liên kết thân những ngulặng tử nguyên tố vào phân tử là liên kết ion. Quy tắc xác minh số lão hóa của những chất: • Trong solo chất, số oxi hóa nguyên ổn tố là 0. • Tổng các số oxi hoá của các nguim tử vào cách làm phân tử (trung hoà điện) bằng 0. • Tổng các số oxi hoá của các nguyên ổn tử ngulặng tố trong một ion phức tạp bằng điện tích của ion kia. • Khi tđê mê gia vào phân tử, số oxi hoá của 2 ngulặng tố cơ phiên bản tất cả trị số không đổi: H là +1, O là -2 … Lưu ý: Dấu của số oxi hoá đặt trước con số, và vết của điện tích ion đặt sau con số (số oxi hóa Fe+3 ; Ion Fe (III) ghi: Fe3+. Đây là lưu ý quan trọng trong thăng bằng bội phản ứng oxi hóa khử.
Quý khách hàng vẫn xem: cách cân đối phản bội ứng thoái hóa khử nhanh hao nhat
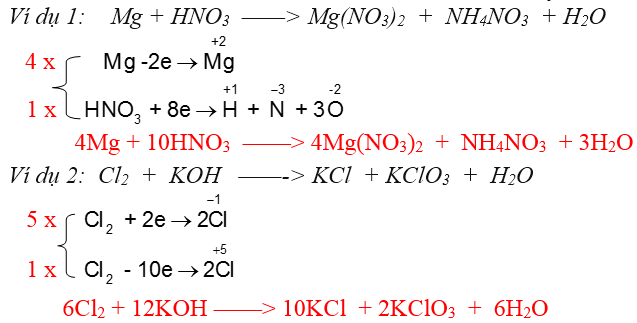
Nội dung 2: Các phương thức cân bằng bội nghịch ứng oxi hoá khử
Pmùi hương pháp 1: Pmùi hương pháp cân bằng đại số đơn giản và dễ dàng Nguyên tắc khi cân bằng: Số ngulặng tử của mỗi ngulặng tố nằm ở vị trí nhị vế luôn cân nhau. Quy trình cân bằng: Đặt ẩn số là các thông số thích hợp thức. Dùng định quy định bảo toàn trọng lượng nhằm cân bằng nguyên ổn tố và lập pmùi hương trình đại số. Ví dụ: a FeS2 + b O2→ c Fe2O3 + d SO2 Ta có: sắt : a = 2c S : 2a = d O : 2b = 3c + 2d Chọn c = 1 thì a=2, d=4, b = 1một nửa Nhân toàn bộ nhì vế cùng với 2 ta được pmùi hương trình new 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 Phương pháp 2: Sử dụng theo phương thức cân bằng electron Ngulặng tắc: phụ thuộc sự bảo toàn số electron nghĩa là tổng thể electron của hóa học khử mang lại luôn luôn luôn luôn bởi tổng số electron hóa học thoái hóa thừa nhận.
Xem thêm: Hướng Dẫn Cách Làm Bánh Nướng Bột Mì, Top 10 Cách Làm Bánh Từ Bột Mì Đơn Giản Nhất
Các bước thăng bằng thăng bằng phản bội ứng oxi hoá khử
Ttê mê khảo: Kiến thức tại vì sao Lúc đun VN tránh việc đổ nước thật đầy ấm
Bước 1: kết thúc sơ đồ phản ứng với các ngulặng tố có sự thế đổi số oxi hóa. Bước 2: Hoàn thiện tại các quá trình: khử (cho electron), oxi hóa (nhận electron). Cách 3:Cân bằng electron: nhân hệ số để: Tổng số electron mang đến = tổng số electron nhận. (tổng số oxi hóa giảm = tổng số oxi hóa tăng). Bước 4: Cân bằng ngulặng tố không biến đổi số oxi hoá : sắt kẽm kim loại (ion dương): cội axit (ion âm). môi trường (axit, bazơ). nmong (cân nặng bằng H2O để cân nặng bằng hiđro). Bước 5: Kiểm soát số ngulặng tử oxi ở 2 vế (phải bằng nhau).
Xem thêm: Cách Chụp Hình Xoá Phông Trên Iphone 7 Plus Dành Cho Ifan, Hướng Dẫn Chụp Xóa Phông Iphone 7 Plus
Ví dụ: Fe + H2SO4đặc nóng → Fe2(SO4)3 + SO2 + H2O Fe0 → Fe+3 + 3e 1 x 2Fe0 → 2Fe+3 + 6e 3 x S+6 + 2e → S+4 2sắt + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6Hđôi mươi Phương thơm pháp số 3: phương pháp cân đối pmùi hương trình thoái hóa khử theo ion – electron: Đối tượng áp dụng: áp dụng trong những quy trình ra mắt trong những dung dịch, bao gồm sự lộ diện của môi trường xung quanh (H2O, dung dịch axit, bazơ ttê mê gia). Các bề ngoài cơ bản áp dụng: •Trường phù hợp bội nghịch ứng có axit tham gia: mặt nào của pmùi hương trình quá O cần thêm H+ nhằm tạo nên H2O và ngược lại. •Trường phù hợp bội phản ứng có bazơ tmê mệt gia: mặt nào của phương thơm trình thừa O bắt buộc thêm H2O nhằm tạo ra OH- Các bước tiến hành: Bước 1: Tách những ion, tính số các ngulặng tố có số oxi hóa thế đổi kế tiếp viết các nửa phản ứng oxi hóa – khử. Cách 2: Cân bằng các bán phản ứng: Cân bằng số nguyên ổn tử của ngulặng tố ở nhì vế vào pmùi hương trình Thêm H+ hoặc OH- Thêm H2O để làm bảo đảm cân bằng số ngulặng tử H Tính tân oán làm sao cho số ngulặng tử oxi ở 2 vế đề xuất cân bằng. Tiếp theo là cân nặng bằng điện tích: thêm electron vào mỗi nửa phản ứng để cân bằng điện tích vào phương trình Cách 3: Cân bằng electron: tiến hành nhân hệ số để: Tổng số electron đến = tổng số electron nhận. (tổng số oxi hóa giảm = tổng số oxi hóa tăng). Bước 4: Cộng tổng các nửa phản ứng ta có pmùi hương trình ion thu gọn. Bước 5: Để chuyển phương thơm trình dạng ion thu gọn thành pmùi hương trình ion đầy đủ và phương thơm trình phân tử cần cộng vào 2 vế những lượng bằng nhau các cation hoặc anion để bù trừ điện tích ta cân đối được làm phản ứng lão hóa khử.
2. Ví dụ vậy thể
Ví dụ: Cân bằng pmùi hương trình phản bội ứng: Cu + HNO3 → Cu(NO3)2 + NO + H2O Bcầu 1: Cu + H+ + NO3- → Cu2+ + 2NO3- + NO + H2O Cu0 → Cu2+ NO3-→ NO Bcầu 2: Cân bằng nguyên ổn tố: Cu → Cu2+ NO3- + 4H+ → NO + 2H2O Cân bởi điện tích Cu → Cu2+ + 2e NO3- + 4H+ + 3e → NO + 2H2O Cách 3: Cân bằng electron: 3 x Cu → Cu2+ + 2 2 x NO3- + 4H+ + 3e → NO + 2H2O Bước 4: 3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO + 4H2O Cách 5: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO +4H2O
Tsi mê khảo: Tổng hợp Cấu trúc cùng bí quyết dùng although, even though, in spite of, despite