Cách Tính Nồng Độ Dung Dịch
Nồng độ mol với nồng độ tỷ lệ của hỗn hợp là quan niệm quan trọng mà những em nên nắm vững để giải những bài bác toán thù tương quan mang lại tính độ đậm đặc mol, tốt độ đậm đặc Xác Suất của dung dịch trước với sau bội phản ứng.
Bạn đang xem: Cách tính nồng độ dung dịch
Vậy độ đậm đặc hỗn hợp là gì? phương pháp cùng phương pháp tính độ đậm đặc mol, mật độ Xác Suất của hỗn hợp như vậy nào? làm sao để kiếm tìm nồng độ dung dịch sau phản nghịch ứng, họ cùng mày mò qua nội dung bài viết này. Đồng thời, vận dụng giải những bài bác tập liên quan cho tính nồng độ mol, độ đậm đặc Phần Trăm của dung dịch trước cùng sau làm phản ứng chất hóa học.
I. Nồng độ phần trăm của dung dịch
1. Ý nghĩa của độ đậm đặc phần trăm
- Nồng độ xác suất của dung dịch mang lại ta biết số gam chất chảy bao gồm vào 100 gam hỗn hợp.
2. Công thức tính độ đậm đặc phần trăm
+ Công thức: C% = .100%
- Trong đó:
C% là nồng độ tỷ lệ của dung dịch
mct là Kăn năn lượng chất tung (gam)
mdd là Kân hận lượng dung dịch (gam); mdd = mdung môi + mhóa học tan
+ Các bí quyết suy ra từ phương pháp tính nồng độ phần trăm
- Công thức tính khối lượng hóa học tan:mct = (C%.mdd):100%
- Công thức tính trọng lượng dung dịch: mdd = (mct.100%):C%
3. Một số ví dụ vận dụng bí quyết tính nồng độ phần trăm
- lấy một ví dụ 1: Hoà tan 10 gam con đường vào 40 gam nước. Tính nồng độ xác suất của hỗn hợp chiếm được.
* Lời giải: Theo bài xích ra, ta có: mdd = mdm + mct = 40+10=50 (gam).
- Áp dụng phương pháp tính nồng độ Tỷ Lệ, ta có:
C% = .100% = (10.100) : 50 = 20%
- lấy một ví dụ 2: Tính cân nặng NaOH tất cả trong 200 gam dd NaOH 15%
* Lời giải: Theo bài ra, ta có:
mNaOH = (C%.mdd):100 = (15%.200):100% = 30 (gam).
- Ví dụ 3: Hoà chảy 20 gam muối hạt vào nước được dd tất cả nồng độ 10%
a) Tính khối lượng dd nước muối hạt thu được
b) Tính trọng lượng nước phải dựng cho sự pha chế
* Lời giải: Theo bài ra, ta có:
a) mdd=(mmuối hạt.100%):C% = (20.100%):10% = 200 (gam).
b) mnước=mdd-mmuối = 200-20 = 180 (gam).
II. Nồng độ Mol của dung dịch
1. Ý nghĩa của mật độ mol dung dịch
- Nồng độ mol của dung dịch cho thấy số mol hóa học tan có trong 1 lít dung dịch
2. Công thức tính nồng nộ mol dung dịch
+ Công thức:
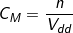
- Trong đó:
CM : là độ đậm đặc mol
n : là số mol chất tan
Vdd : là thể tích dung dịch (lít)
+ Các phương pháp suy ra tự bí quyết tính mật độ mol của dung dịch
- Công thức tính số mol chất tan: n = CM.Vdd (mol).
- Công thức tính thể tích dung dịch:
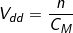
3. Một số ví dụ áp dụng cách làm tính nồng độ mol
- lấy ví dụ như 1: Trong 200 ml dd có hoà tan 16 gam NaOH. Tính độ đậm đặc mol của dd.
* Lời giải:
- Đổi: 200ml=0,2 lít; theo bài xích ra, ta có:
nNaOH=16/40=0,4 (mol).
- Áp dụng công thức tính nồng độ mol: CM=n/V=0,4/0,2 = 2 (M).
- ví dụ như 2: Tính cân nặng H2SO4 bao gồm vào 50ml dd H2SO4 2M
* Lời giải:
- Tính số mol H2SO4 gồm trong dd H2SO4 2M.
nH2SO4 = CM.V=2.0,05 =0,1 (mol).
⇒ mH2SO4 = n.M=0,1.98=9,8 (gam).
III. Bài tập tính nồng độ xác suất với nồng độ mol dung dịch
Bài 1 trang 145 sgk hoá 8: Bằng biện pháp nào dành được 200g dung dịch BaCl2 5%.
A. Hòa tan 190g BaCl2 vào 10g nước.
B. Hòa tan 10g BaCl2 trong 190g nước.
C. Hoàn chảy 100g BaCl2 trong 100g nước.
D. Hòa tan 200g BaCl2 vào 10g nước.
E. Hòa tan 10g BaCl2 trong 200g nước.
* Lời giải bài 1 trang 145 sgk hoá 8:
- Đáp án đúng: B.Hòa chảy 10g BaCl2 trong 190g nước.
- Áp dụng phương pháp suy ra từ bỏ CT tính nồng độ Phần Trăm, ta có:
mct = (C%.mdd)/100% = (5%.200)/100% = 10 (g).
mà mdd = mct + mnước ⇒ mnước = mdd - mct = 200 – 10 = 190 (g).
Bài 2 trang 145 sgk hoá 8: Tính độ đậm đặc mol của 850ml hỗn hợp bao gồm kết hợp 20g KNO3.Kết trái là:
a) 0,233M. b) 23,3M.
c) 2,33M. d) 233M.
* Lời giải bài xích 2 trang 145 sgk hoá 8:
- Đáp số đúng: a. 0,233M.
Xem thêm: Cách Mở Trang Web Ẩn Danh (Incognito Mode) Là Gì? Để Làm Gì? Có An Toàn Không?
- Theo bài bác ra, ta có:nKNO3 = 20/101 = 0,198 (mol).
- 850 ml = 0,85 (lít) ⇒ CM (KNO3) = n/V = 0,198/0,85 = 0,233 (M).
Bài 3 trang 146 sgk hoá 8: Hãy tính độ đậm đặc mol của từng dung dịch sau:
a) 1 mol KCl trong 750ml dung dịch.
b) 0,5 mol MgCl2 trong một,5 lkhông nhiều dung dịch.
c) 400g CuSO4 vào 4 lkhông nhiều dung dịch.
d) 0,06 mol Na2CO3 trong 1500ml dung dịch.
* Lời giải bài bác 3 trang 146 sgk hoá 8:
- Áp dụng bí quyết tính mật độ mol: CM = n/V.
- Lưu ý: các em nhớ thay đổi đơn vị thể tích trường đoản cú ml quý phái lít.
a) 1 mol KCl ⇒ nKCl = 1; 750ml hỗn hợp = 0,75 lkhông nhiều dung dịch ⇒ Vdd = 0,75 (l).
⇒ CM (KCl) = n/V = 1/0,75 = 1,33 (M).
b) CM (MgCl2) = n/V = 0,5/1,5 = 1,33 (M).
c) nCuSO4 = 400/160 = 2,5 (mol)
⇒ CM (CuSO4) = 2,5/4 = 0,625 (M).
d) CM (Na2CO3) = 0,06/1,5 = 0,04 (M).
Bài 4 trang 146 sgk hoá 8: Hãy tính số mol cùng số gam hóa học rã trong mỗi hỗn hợp sau:
a) 1 lít hỗn hợp NaCl 0,5M.
b) 500ml dung dịch KNO3 2M.
c) 250ml dung dịch CaCl2 0,1M.
d) 2 lít hỗn hợp Na2SO4 0,3M.
* Lời giải bài 4 trang 146 sgk hoá 8:
- Áp dụng phương pháp suy ra trường đoản cú phương pháp tính độ đậm đặc mol: n = CM.V
- Và phương pháp tính kân hận lượng: m = n.M
a) 1 lkhông nhiều dung dịch NaCl 0,5M ⇒ Vdd = 1 lít; CM = 0,5M.
⇒ nNaCl = CM.V = 1.0,5 = 0,5 (mol) ⇒ mNaCl = m = n.MNaCl = 0,5.(23 +35,5) = 29,25 (g).
b) nKNO3 = 2.0,5 = 1 (mol) ⇒ mKNO3 = 1.101 = 101 (g).
c) nCaCl2 = 0,1.0,25 = 0,025 (mol) ⇒ mCaCl2 = 0,025.(40 + 71) = 2,775 (g).
d) nNa2SO4 = 0,3.2 = 0,6 (mol) ⇒ mNa2SO4 = 0,6.142 = 85,2 (g).
Bài 5 trang 146 sgk hoá 8: Hãy tính mật độ Tỷ Lệ của không ít dung dịch sau:
a) 20g KCl trong 600g hỗn hợp.
b) 32g NaNO3 trong 2kg dung dịch.
c) 75g K2SO4 vào 1500g dung dịch.
* Lời giải bài 5 trang 146 sgk hoá 8:
- Áp dụng phương pháp tính độ đậm đặc Phần Trăm.
- Lưu ý: thay đổi đơn vị trọng lượng từ kg sang gam.
a) C% (KCl) = (mct.100%)/mdd = (20.100%)/60 = 3,33%
b) 2kilogam = 2000 (g).
Xem thêm: Cách Làm Thịt Quay Bằng Lò Nướng, Thịt Quay Giòn Giòn Bằng Lò Nướng Tại Nhà
⇒ C% (NaNO3) = (32.100%)/2000 = 1,6%
c) C% (K2SO4) = (75.100%)/1500 = 5%.
Bài 6 trang 146 sgk hoá 8: Tính số gam chất tung đề nghị dùng để điều chế mỗi dung dịch sau: